|
医疗器械注册质量管理体系规范考核申请需要哪些材料?医疗器械产品注册质量管理体系规范考核办理流程?医疗器械咨询根据《医疗器械质量管理体系规范考核办事指南》医疗器械质量管理体系规范考核申请材料要求:
1. 医疗器械产品注册质量管理体系核查提交材料目录
注:三类、二类医疗器械注册质量管理体系核查资料要分开提交。
(1)《医疗器械生产企业(注册申请人)基本情况表》(在递交书面申请材料前,应通过企业网上办事平台网上申报电子版申请材料(网上申报操作指引.pdf),上报的《申请表》纸质文档应与网络填写内容、格式保持一致,不得随意更改,并取得预受理号,企业在提交纸质申请材料时须同时提交该预受理号);
(2)医疗器械质量管理体系核查确认书;
(3)营业执照副本复印件;
(4)企业组织机构图;
(5)企业负责人、生产、技术和质量管理部门负责人简历,学历和职称证书复印件;
(6)部分医疗器械产品注册申报资料的复印件:
1、医疗器械(不包括体外诊断试剂):研究资料、产品技术要求、注册检验报告、临床试验报告(如有)、医疗器械安全有效基本要求清单。
2、体外诊断试剂:主要生产工艺及反应体系的研究资料(第三类体外诊断试剂)、产品技术要求、注册检验报告、临床试验报告(如有)。
3、医疗器械产品注册代理注册受理回执复印件
注:如不需要临床试验的,提供无临床试验报告的声明。
(7)如生产过程有净化要求的应提供省级食品药品监督管理部门认可的检测机构(如:广东省医疗器械质量监督检验所、广东省药品检验所等)出具的生产车间、无菌操作室、微生物限度检测室环境检测报告复印件;
(8)生产场地证明文件,包括房产证明或租赁协议和出租方的房产证明的复印件份(持有医疗器械生产许可证的企业免予提交) ; 厂区总平面图,主要生产车间布置图,有洁净要求的车间,须标明功能间及人物流走向;
(9)产品生产工艺流程图,应标明主要控制点与项目及主要原材料、采购件的来源及质量控制方法。
(10)主要生产设备和检验设备(包括进货检验、过程检验、出厂的最终检验相关设备;如需净化生产的,还应提供环境监测设备)目录;
(11)拟核查产品与既往已通过核查产品在生产条件、生产工艺等方面的对比说明(如适用)。
(12)针对不同产品按照食品药品监管总局关于印发医疗器械生产质量管理规范现场检查指导原则等4个指导原则的通知( 食药监械监〔2015〕218号)进行自查的《企业质量管理体系自查报告》(格式不限,企业自行撰写)。
注1:医疗器械注册代理如企业没有如实填写、认真自查,经资料审查认为自查不合格的将作退审处理。
注2:需净化生产的医疗器械应设立洁净度为一万级的无菌操作室、微生物室限度检验室,阳性对照室。
注3:工艺流程要求:按照《医疗器械生产质量管理规范》要求,工艺流程包括从物料开始到产品放行全过程,流程图中应体现清洁处理或从产品上去除处理物、加工、监测和测量的过程,并且要标示生产环境,关键工序和特殊过程,反之,认为工序不全。工序中如有外包加工的,要标示出来,并且写明委托企业名称。
2.医疗器械注册代理申请整改后复核的企业只需提交下列资料:
(1)《医疗器械生产企业(注册申请人)基本情况表》,(自查合格并经法定代表人签字并加盖公章后,提出质量管理规范检查申请);
(2)上次的医疗器械生产企业质量管理体系考核报告或核查结果通知原件;
(3)整改落实情况报告及证明资料;
(4)医疗器械质量管理体系核查确认书。
3.医疗器械产品注册代理申请体外诊断试剂质量管理体系考核范围有效覆盖提交以下资料
(1)《医疗器械生产企业(注册申请人)基本情况表》一份
(2)质量信用A类医疗器械生产企业通知复印件;
(3)体外诊断试剂质量管理体系考核范围有效覆盖的情况说明,应包括以下内容:
①申请体外诊断试剂质量管理体系考核范围有效覆盖的依据及产品所属类别,类别应符合《关于印发体外诊断试剂质量管理体系考核范围有效覆盖判定原则及认定程序的通知》(国食药监械[2009]320号)附表1的分类,并应明确是否为病原微生物、激素、毒品;
② 申请覆盖产品与已通过考核的同类型品种剂型(干粉或液体)的说明,应明确是否一致;
③ 企业增加新产品后,厂房、设施和设备应与体外诊断试剂生产的品种数量和/或规模相适应的说明;
④申请覆盖产品与已通过考核的同类型品种的生产所需净化级别的说明;
⑤申请覆盖产品与已通过考核的同类型品种的原理、生产工艺和控制过程的对比说明,应明确异同点;
⑥申请覆盖产品与已通过考核的同类型品种质量管理体系要素的异同点,一般应包括以下内容:设施、设备与生产环境控制、设计控制与验证、采购控制、生产过程控制、检验与质量控制等;
⑦申请覆盖产品与已通过考核的同类型品种的主要原材料来源的说明,应明确是否为外购。
(4)生产平面布置图,生产规模与生产场所相适应的说明;
(5)本次申请产品的分类依据及上市审批的情况;
(6)已通过考核的同类型品种有效的《体外诊断试剂生产企业质量管理体系考核报告》复印件;
(7)提交材料真实性自我保证声明。
医疗器械注册质量管理体系申请材料真实性的自我保证声明,并对材料作出如有虚假承担法律责任的承诺。
真实性自我保证声明应由申请企业法定代表人或负责人签字并加盖企业公章,并包括以下内容:所提交的申请材料清单、生产企业承担相应法律责任的承诺。
注: 取得覆盖报告后须申请体外诊断试剂研制情况现场核查的,应提交以下资料,1份:
(1)《医疗器械生产企业(注册申请人)基本情况表》;
(2)已完成的体外诊断试剂生产企业质量体系考核报告复印件或有效涵盖报告复印件;
(3)拟医疗器械产品注册的“综述资料”,包括以下内容
①立项情况(主要人员及分工,研究时间、试验报告者);
②项目涉及的主要设备、仪器(注明设备仪器的型号);
③试制场地及试制样品情况(批号、批量、数量);
④各个阶段的样品使用情况(包括工艺研究、标准研究、稳定性研究、检验、临床试验等),样品贮存条件;留样情况;
⑤委托研究或承担机构的情况
⑥其它
(4)各临床单位临床试验报告的封面及标有临床用样品批号的内容部分复印件。
(5)检查确认书
4.申请材料形式标准
医疗器械产品注册证质量管理体系申请材料应真实、完整,统一用A4纸双面打印或复印,按照申请材料目录顺序装订成册。凡申请材料需提交复印件的,申请人(单位)须在复印件上注明“此复印件与原件相符”字样或者文字说明,并逐份加盖企业公章。
5.医疗器械注册证质量管理体系申报资料的具体要求
(1)《医疗器械生产企业(注册申请人)基本情况表》需要企业法定代表人签名,加盖企业公章。
(2)《自查报告》需由企业管理者代表核对并签字。
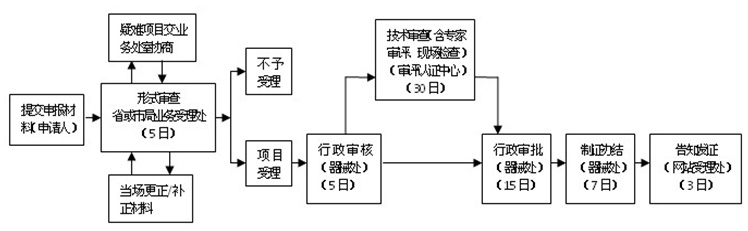
医疗器械注册咨询根据《医疗器械质量管理体系规范考核办事指南》医疗器械产品注册质量管理体系规范考核办理流程如下图:
深圳鸿远医疗器械咨询有限公司专业的 医疗器械产品注册证咨询代理代办、医疗器械生产许可证、三类医疗器械经营许可证、二类医疗器械经营备案、进口医疗器械注册、一类医疗器械产品备案及生产备案、FDA注册、ISO13485认证、 CE认证、计量器具生产许可证、临床试验、出口证,自由销售证等代理代办、医疗器械质量管理体系认证文件的建立及体系与过程确认文件的建立 (如:ISO9001、 ISO13485 、GMP、 CE、QSR820、CMDCAS)产品检测,临床试验及免临床资料编写、产品技术要求制订、技术文件编写辅导、医疗器械广告批文申请办理、洁净室建设指导等服务,技术专业,诚信服务,代理费用低,欢迎您咨询!
|