|
医疗器械注册据广东省食品药品监督管理局2017年9月9日发布的《106-010 医疗器械说明书变更审查》文件,广东省医疗器械产品注册说明书变更审查具体要求如下:
一:许可事项名称:
医疗器械说明书变更
二、许可事项的法律依据:
1. 《医疗器械注册管理办法》(国家食品药品监督管理总局令第4号)
2.《医疗器械说明书和标签管理规定》(国家食品药品监督管理总局令第6号)
三、医疗器械注册代理许医疗器械说明书变更审查许可数量及方式
无数量限制
四、许可条件:
1. 广东省食品药品监督管理局核发的医疗器械注册证,注册证在有效期内。
2. 已注册的医疗器械未发生注册变更的,说明书内容发生变化。
五、医疗器械产品注册代理医疗器械说明书变更审查申请资料目录及说明:
材料1、医疗器械说明书变更申请表:医疗器械说明书变更申请表是重要资料之一,要求表中各项内容填写准确,法定代表人签字,加盖企业公章,不得涂改。
材料2、资格证明文件:注册人营业执照副本、组织机构代码证和生产企业许可证副本的复印件,并加盖企业公章。
材料3、医疗器械说明书变更情况对比说明:详细说明变更情况,必要时提交支持资料。
材料4、已核发的产品技术要求复印件、变更前、后医疗器械说明书。
材料5、所提交资料真实性的自我保证声明:包括所提交材料真实有效的承诺,并加盖企业公章。
六、医疗器械注册说明书变更审查申请材料一般要求
在递交书面申报材料前,应通过企业网上办事平台(http://219.135.157.143)网上申报《医疗器械说明书变更》的电子版申请材料,并上传相应电子版(网上申报操作指引.pdf),取得预受理号,并在1个月内提交书面申请。企业在提交纸质申请材料时须同时提交预受理号。
1. 医疗器械产品注册说明书变更审查申请材料应清晰、整洁,使用A4规格纸张打印;
2. 每项文件均应加盖企业公章;
3. 按照申请材料目录的顺序装订成册;
4. 用档案袋将报送的材料装好,档案袋需使用封面,格式见“档案袋封面格式”
5. 医疗器械产品注册代办办理医疗器械说明书变更事务的人员应当受申请人委托,应出示授权委托书及该办理人身份证明原件与复印件。
六、申请地点:广州市东风东路753号之二一楼业务受理处
申请时间:周一至周五上午9:00—12:00,下午13:00—17:00(周五下午不对外办公)
七、医疗器械注册代办医疗器械说明书变更审查办理程序
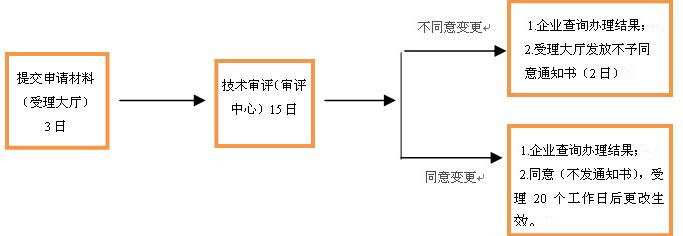
注:以上期限以工作日计算,不含法定节假日。
八、医疗器械注册咨询说明书变更审查申请表格及文件下载:
1 医疗器械说明书变更申请表
2. 档案袋封面格式
深圳鸿远医疗器械咨询有限公司 http://www.hongyuanyixiezixun.com专业的医疗器械注册代理代办、医疗器械生产许可证、三类医疗器械经营许可证、二类医疗器械经营备案、进口医疗器械注册、一类医疗器械产品备案及生产备案、FDA注册、ISO13485认证、 CE认证、计量器具生产许可证、临床试验、出口证,自由销售证等代理代办、医疗器械质量管理体系认证文件的建立及体系与过程确认文件的建立 (如:ISO9001、 ISO13485 、GMP、 CE、QSR820、CMDCAS)产品检测,临床试验及免临床资料编写、产品技术要求制订、技术文件编写辅导、医疗器械广告批文申请办理、洁净室建设指导等服务,技术专业,诚信服务,代理费用低,欢迎您咨询!
|