|
医疗器械注册对于新研发医疗器械分类目录里没有的新产品无法确定类别时,我们首先要做的就是申请医疗器械分类界定,搞清楚类别。那么医疗器械分类办界定怎么办理呢?
依据《总局办公厅关于规范医疗器械产品分类有关工作的通知》(食药监办械管〔2017〕127号中“(三)标管中心负责对进口及港、澳、台产品的分类界定申请和省级食品药品监督管理部门出具预分类界定意见的分类界定申请组织研究审核”。
依据《总局办公厅关于规范医疗器械产品分类有关工作的通知》(食药监办械管〔2017〕127号)
一、申请方式
申请人通过中国食品药品检定研究院(国家食品药品监督管理总局医疗器械标准管理中心)网站进入“医疗器械标准管理研究所”二级网站的“医疗器械分类界定信息系统”页面点击进入“医疗器械分类界定信息系统”,注册后填写《分类界定申请表》,并上传其他申请材料。
在线打印《分类界定申请表》,连同其他申请材料(应与上传的申请材料完全相同)加盖申请企业骑缝章,寄送至相关单位。境内产品的相关材料寄至申请企业所在地的省级食品药品监督管理部门,进口及港、澳、台产品的相关材料寄送至国家食品药品监督管理总局医疗器械标准管理中心(地址:北京市大兴区生物医药产业基地华佗路31号院4号楼B404房间,邮编:102629)。
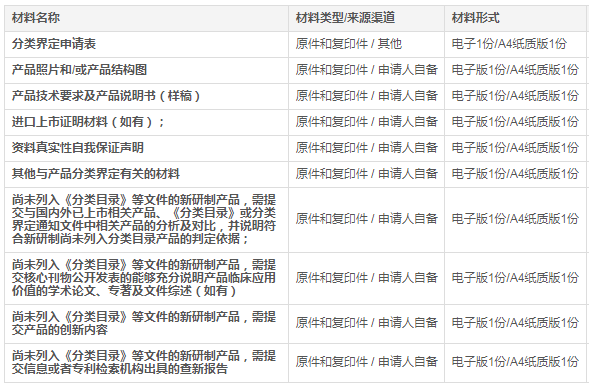
二、医疗器械分类界定申请材料要求
(一)分类界定申请表;
(二)产品照片和/或产品结构图;
(三)产品技术要求及产品说明书(样稿);
(四)进口上市证明材料(如有);
(五)资料真实性自我保证声明;
(六)其他与产品分类界定有关的材料。其中对于尚未列入《分类目录》等文件的新研制产品,至少还应当提交:
1.与国内外已上市相关产品、《分类目录》或分类界定通知文件中相关产品的分析及对比,并说明符合新研制尚未列入分类目录产品的判定依据;
2.核心刊物公开发表的能够充分说明产品临床应用价值的学术论文、专著及文件综述(如有);
3.产品的创新内容;
4.信息或者专利检索机构出具的查新报告。
所有申请材料应当使用中文。根据外文资料翻译的,应当同时提供原文。
医疗器械分类界定申请材料目录:
医疗器械分类界定流程:
依据《总局办公厅关于规范医疗器械产品分类有关工作的通知》(食药监办械管〔2017〕127号)
标管中心负责对进口及港、澳、台产品的分类界定申请和省级食品药品监督管理部门出具预分类界定意见的分类界定申请组织研究审核。
标管中心对进口及港、澳、台产品的分类界定申请和省级食品药品监督管理部门出具预分类界定意见的分类界定申请组织审核后,认为属于《分类目录》等文件中的医疗器械的,标管中心直接在分类界定信息系统告知申请人分类界定结果;认为属于新研制的尚未列入《分类目录》等文件中的医疗器械的,组织医疗器械分类技术委员会相关专业组研究提出产品分类技术建议,标管中心复核后在分类界定信息系统告知申请人。标管中心应当自其受理分类界定申请之日起20个工作日内完成类别确认工作。需要补充资料的,申请人应当在30个工作日内按照补正通知的要求一次提供补充资料。如申请人未按要求提交补充资料,或逾期未提交补充资料的,标管中心将退回申请。补充资料及专家研讨所需时间不计算在时限内。
医疗器械分类界定需要多长时间?
法定办结时限说明:
属于新研制的尚未列入《医疗器械分类目录》等文件中的医疗器械的,标管中心应当自其受理分类界定申请之日起20个工作日内完成类别确认工作。补充资料及专家研讨所需时间不计算在时限内。其他情况的分类界定申请暂无办理时限规定。
承诺办结时限说明:
属于新研制的尚未列入《分类目录》等文件中的医疗器械的,标管中心应当自其受理分类界定申请之日起20个工作日内完成类别确认工作。补充资料及专家研讨所需时间不计算在时限内。其他情况的分类界定申请暂无办理时限规定。
医疗器械产品注册新产品申请分类界定结果图例:

深圳鸿远医疗器械咨询有限公司是一家技术专业的医疗器械咨询公司,专注提供全国各地如:深圳、广州、东莞、中山、佛山、潮州、顺德、上海、西安、重庆、成都等知名城市的医疗器械领域技术咨询服务。鸿远医疗器械咨询专业服务于:医疗器械产品注册证、医疗器械生产许可证、进口医疗器械注册、体外诊断试剂注册代办理咨询、一类医疗器械产品备案及生产备案代办、医疗器械经营许可证代办、二类医疗器械经营备案、医疗器械分类界定代办、CE认证、ISO13485认证、FDA注册、临床试验、医疗器械质量管理体系认证及体系建立与过程确认文件建立(ISO9001, ISO13485, GMP, CE,QSR820,CMDCAS);产品技术要求制订、技术文件、临床试验及免临床同类产品比对比资料编写、注册资料编写辅导、电磁兼容预测整改、医疗器械广告批文申报、医疗器械出口销售证明办理、洁净室建设指导等提供一站式服务,技术专业,诚信服务,欢迎您咨询!
|