|
什么是医疗器械?哪些产品能申请医疗器械注册证呢?医疗器械,是指单独或者组合使用于人体的仪器、设备、器具、材料或者其他物品,包括所需要的软件;其用于人体体表及体内的作用不是用药理学、免疫学或者代谢的手段获得,但是可能有这些手段参与并起一定的辅助作用;其使用旨在达到下列预期目的:
(一)对疾病的预防、诊断、治疗、监护、缓解;
(二)对损伤或者残疾的诊断、治疗、监护、缓解、补偿;
(三)对解剖或者生理过程的研究、替代、调节;(四)妊娠控制。非医疗器械不得申请医疗器械注册证。
申请第二类医疗器械产品注册,注册申请人应当向所在地省、自治区、直辖市人民政府食品药品监督管理部门提交注册申请资料。 境内第二类、第三类医疗器械注册质量管理体系核查,由省、自治区、直辖市食品药品监督管理部门开展,其中境内第三类医疗器械注册质量管理体系核查,由国家食品药品监督管理总局技术审评机构通知相应省、自治区、直辖市食品药品监督管理部门开展核查,必要时参与核查。
《医疗器械监督管理条例》(国务院令第680号)第十一条:申请第二类医疗器械产品注册,注册申请人应当向所在地省、自治区、直辖市人民政府食品药品监督管理部门提交注册申请资料。
审查方式:书面审查。标准如下: (一)申请书(表)的审查标准如下:
1.申请人应如实填写各项内容,对提交材料的真实性、完整性负责,不得虚构、伪造或编造事实;
2.文书应使用钢笔和能够长期保持字迹的墨水填写或打印,做到字迹清楚、文字规范、文面整洁,不得涂改。文书设定的栏目,应逐项填写完整、准确;
3.申请材料中的表格应使用国际标准A4纸正面印制;
4.相关申请表格应由申请相对人、申请单位填写并本人签名、加盖单位公章,没有单位印章的,应由其单位负责人签名。”实地核查。标准如下:根据《医疗器械注册管理办法》要求进行技术审查。
广西壮族自治区医疗器械注册依据一、《医疗器械注册管理办法》(国家食品药品监督管理总局令第4号) 第三十三条 受理注册申请的食品药品监督管理部门应当自受理之日起3个工作日内将申报资料转交技术审评机构。技术审评机构应当在60个工作日内完成第二类医疗器械注册办理的技术审评工作,在90个工作日内完成第三类医疗器械注册的技术审评工作。需要外聘专家审评、药械组合产品需与药品审评机构联合审评的,所需时间不计算在内,技术审评机构应当将所需时间书面告知申请人。
广西壮族自治区医疗器械产品注册依据二、 第一类医疗器械实行备案管理。第二类、第三类医疗器械实行注册管理。 境内第一类医疗器械备案,备案人向设区的市级食品药品监督管理部门提交备案资料。 境内第二类医疗器械由省、自治区、直辖市食品药品监督管理部门审查,批准后发给医疗器械注册证。 境内第三类医疗器械由国家食品药品监督管理总局审查,批准后发给医疗器械注册证。 进口第一类医疗器械备案,备案人向国家食品药品监督管理总局提交备案资料。 进口第二类、第三类医疗器械由国家食品药品监督管理总局审查,批准后发给医疗器械产品注册证。 香港、澳门、台湾地区医疗器械的注册、备案,参照进口医疗器械办理。
申请第二类医疗器械注册,注册申请人应当向所在地省、自治区、直辖市人民政府食品药品监督管理部门提交注册申请资料
广西壮族自治区医疗器械产品注册证办理材料及目录:
1、医疗器械首次注册申请表
2、证明性文件
3、医疗器械安全有效基本要求清单
4、综述资料
5、研究资料
6、生产制造信息
7、临床评价资料
8、产品技术要求
9、产品注册检验报告
10、说明书和标签样稿
11、符合性声明
12、医疗器械注册质量管理体系核查材料
医疗器械注册代理注册申请人必需按以下材料提交:
a、注册申请人基本情况表(见附件);
b、注册申请人组织机构图;
c、企业负责人、生产、技术和质量管理部门负责人简历,学历和职称证书复印件;
e、企业总平面布置图、生产区域分布图;5如生产过程有净化要求的应提供食品药品监督管理部门认可的检测机构出具的生产车间、无菌检测室、微生物限度检测室、阳性对照间一年内环境检测报告(附平面布局图)复印件。
f、产品工艺流程图;
g、主要生产设备和检验设备(包括进货检验、过程检验、出厂的最终检验相关设备;如需净化生产的,还应提供环境监测设备)目录;
h、企业自查报告;
k、拟核查产品与既往已通过核查产品在生产条件、生产工艺等方面变化情况的说明(如适用)。
广西壮族自治区申请第二类医疗器械产品(不含第二类体外诊断试剂)首次注册受理条件:
在广西辖区内申请第二类医疗器械产品(不含第二类体外诊断试剂)首次注册的企业。
第二类医疗器械产品注册审批——第二类医疗器械产品(不含第二类体外诊断试剂)首次注册流程图:
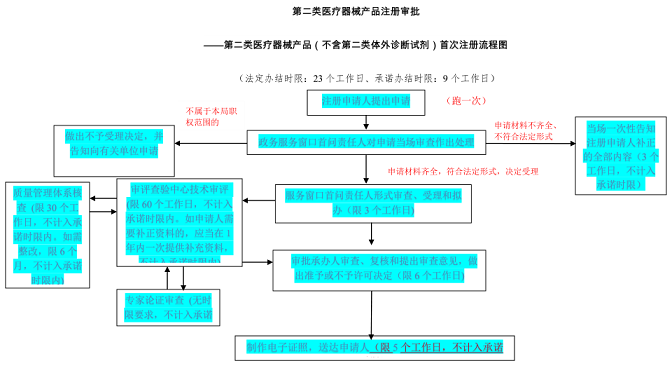
医疗器械产品注册证代理广西壮族自治区医疗器械产品注册收费标准:
广西壮族自治区第二类医疗器械产品首次注册30280元/次。
深圳鸿远医疗器械咨询有限公司是一家技术专业的医疗器械咨询公司,专注提供全国各地如:深圳、广州、东莞、中山、佛山、潮州、顺德、广西、上海、西安、重庆、成都等知名城市的医疗器械领域技术咨询服务。鸿远医疗器械咨询专业服务于:医疗器械注册证代理、医疗器械生产许可证、进口医疗器械注册、体外诊断试剂注册代办理咨询、一类医疗器械产品备案及生产备案代办、医疗器械经营许可证代办、二类医疗器械经营备案、医疗器械分类界定、CE认证、ISO13485认证、FDA注册、临床试验、医疗器械质量管理体系认证及体系建立与过程确认文件建立(ISO9001, ISO13485, GMP, CE,QSR820,CMDCAS);产品技术要求制订、技术文件、临床试验及免临床同类产品比对比资料编写、注册资料编写辅导、电磁兼容预测整改、医疗器械广告批文申报、医疗器械出口销售证明办理、洁净室建设指导等提供一站式服务,技术专业,诚信服务,欢迎您咨询!
|