|
医疗器械注册代理
医疗器械产品注册电动轮椅车产品技术要求2017年修订版应包括的主要性能指标如下:
医疗器械电动轮椅车产品技术指导原则给出需要考虑的产品基本技术性能指标,给出了推荐要求,医疗器械注册申请人可参考相应的国家标准、行业标准,根据自身产品的技术特点制定相应的指标,但不得低于相关强制性国家标准、行业标准的有关要求。
根据中华人民共和国标准化法有关规定,鼓励企业采用推荐性标准。申请人如果有其他科学依据证明医疗器械安全有效的,也可采用其他的方法。申请人可以在医疗器械产品技术要求中直接采用推荐性标准,也可以通过其他方法证明产品符合安全有效的要求。如果申请人在产品技术要求中引用了推荐性标准的性能指标和检验方法,即申请人把推荐性标准作为本注册人承诺的技术要求,则其上市的医疗器械应符合产品技术要求及引用的推荐性标准的要求。
如有不适用条款(包括国家标准、行业标准要求),申请人在研究资料的产品性能研究中应说明理由。
医疗器械产品注册技术要求中的性能指标是指可进行客观判定的指标,所引用标准中注明申请人规定的指标需给出具体的内容:
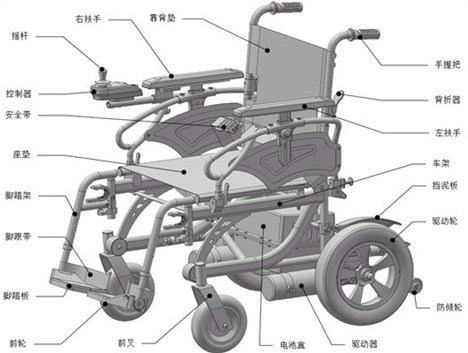
1.应符合GB/T 12996—2012《电动轮椅车》中适用部分的要求。
2.电气安全
应符合GB 9706.1—2007《医用电气设备第1部分:安全通用要求》的要求。
3.电磁兼容
医疗器械产品注册代理应符合YY 0505—2012《医用电气设备第1-2部分安全通用要求并列标准电磁兼容要求和试验》及GB/T 18029.21—2012《轮椅车第21部分电动轮椅车、电动代步车和电池充电器的电磁兼容性要求和测试方法》的要求。
4.环境试验
应符合GB/T 14710—2009《医用电器环境要求及试验方法》及GB/T 18029.9—2008《轮椅车第9部分:电动轮椅车气候试验方法》的要求。
5.辅助功能(若有)
若申请人声称含有特殊的辅助功能,应根据自身技术特点,制定相应的性能指标。如程控装置、安全带等。
6.软件功能(若有)
医疗器械注册代理若申报产品含有软件组件,软件组件应在医疗器械产品技术要求中进行规范,其中“产品型号/规格及其划分说明”应明确软件的名称、型号规格、发布版本、版本命名规则、运行环境(控制型软件组件适用,包括硬件配置、软件环境和网络条件),而“性能指标”应明确软件全部临床功能纲要。
深圳鸿远医疗器械咨询有限公司专业的医疗器械产品注册代理代办、医疗器械生产许可证、三类医疗器械经营许可证、二类医疗器械经营备案、进口医疗器械注册、一类医疗器械产品备案及生产备案、FDA注册、ISO13485认证、 CE认证、计量器具生产许可证、临床试验、出口证,自由销售证等代理代办、医疗器械质量管理体系认证文件的建立及体系与过程确认文件的建立 (如:ISO9001、 ISO13485 、GMP、 CE、QSR820、CMDCAS)产品检测,临床试验及免临床资料编写、产品技术要求制订、技术文件编写辅导、医疗器械广告批文申请办理、洁净室建设指导等服务,技术专业,诚信服务,代理费用低,欢迎您咨询!
|