|
医疗器械注册办理一次性使用胆红素血浆吸附器产品技术要求应当按照《医疗器械产品技术要求编写指导原则》(国家食品药品监督管理总局通告2014年第9号)的规定编制产品技术要求,技术指标应当不低于国家标准、行业标准要求,引用标准应当为现行有效版本。对企业宣称的所有技术参数和功能,应在产品技术要求中予以规定。
胆红素血浆吸附器的医疗器械注册产品技术要求应参照YY 1290-2016等标准,以及产品设计验证结果、临床应用相关报告与文献来制定。申报产品型号、规格划分尽量采用国家标准、行业标准的表示方法,所有产品的组件、材料对应关系应明确,不用“系列”“等”含糊用词。
1.产品型号/规格及其划分说明
医疗器械产品注册提供产品规格型号、结构组成示意图,列明各组件名称及制造材料(准确化学名称、金属牌号及常用名)、填充液、灭菌方法、有效期、包装材料等要求。应明确吸附剂类型、各规格产品之间区别(用湿态吸附剂体积来区分),建议明确最大使用压力。同时规定胆红素血浆吸附器原材料不得人为添加已列入相关法规及文件禁止的或未经毒理学评估的物质。
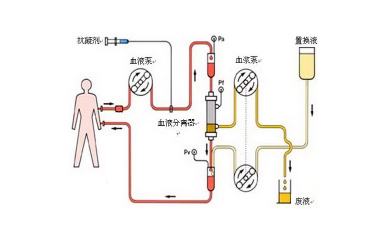
2.性能指标
(1)物理特性
①胆红素血浆吸附器各组件外观、尺寸、血室容量、血浆进出端与管路的连接、微粒脱落、密封性能、耐温性能等指标。所有组件应具有各自性能要求。如包含特殊组件、结构,应规定其尺寸、性能要求。如产品带有涂层,建议提供涂层成分、性能特性等规定。
②使用特性
对胆红素的吸附性能、总蛋白吸附率等指标。如包含特殊功能,应规定相应功能要求。
(2)化学性能要求
还原物质(易氧化物)、金属离子、酸碱度、蒸发残渣、吸光度、化学物残留(如适用)等。
(3)其他性能
医疗器械注册代理根据胆红素血浆吸附器与人体接触方式及时间等,规定无菌、细菌内毒素、热原等其他要求。
3.检验方法
有关行业标准、国家标准规定各个性能技术指标的检测方法,应作为各条款对应的检测方法。
4.术语(如适用)
深圳鸿远医疗器械咨询有限公司是一家技术专业的医疗器械咨询服务公司,专注提供全国各地如:深圳、广州、东莞、中山、佛山、潮州、顺德、上海、西安、重庆、成都等知名城市的医疗器械领域技术咨询服务。专业的医疗器械产品注册代理代办、医疗器械生产许可证、三类医疗器械经营许可证、二类医疗器械经营备案、进口医疗器械注册、一类医疗器械产品备案及生产备案、FDA注册、ISO13485认证、 CE认证、计量器具生产许可证、临床试验、出口证,自由销售证等代理代办、医疗器械质量管理体系认证文件的建立及体系与过程确认文件的建立 (如:ISO9001、 ISO13485 、GMP、 CE、QSR820、CMDCAS)产品检测,临床试验及免临床资料编写、产品技术要求制订、技术文件编写辅导、电磁兼容整改、医疗器械广告批文申请办理、洁净室建设指导等服务,技术专业,诚信服务,代理费用低,欢迎您咨询!
|