|
医疗器械注册血糖仪产品怎么编写技术资料?医疗器械血糖仪产品注册技术审查指导原则是什么?医疗器械产品注册证办理技术资料编写要求是什么?
答:血糖仪注册技术审查指导原则编写说明要求如下:
一、指导原则编写的目的和背景
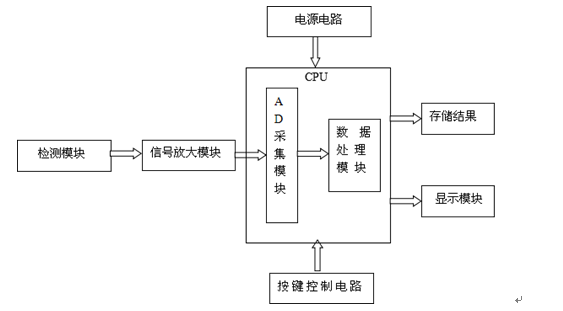
医疗器械血糖仪产品的结构线路图:
(一)本指导原则的编写目的是指导和规范血糖仪产品的技术审评工作,旨在帮助审评人员理解和掌握该类产品原理/机理、结构、性能、预期用途等内容,把握技术审评工作基本要求和尺度,对产品安全性、有效性作出系统评价。
(二)随着《医疗器械监督管理条例》的颁布实施,《医疗器械注册管理办法》及相关配套文件的下发,原来制定的血糖仪产品注册技术指导原则已不再符合当前法规的要求,本次依照新法规对进行修订,以适应当前法规要求。
二、指导原则编写的依据
(一)《医疗器械监督管理条例》(中华人民共和国国务院令第650号)
(二)《医疗器械注册管理办法》(国家食品药品监督管理总局令第4号)
(三)《关于发布医疗器械产品技术要求编写指导原则的通告》(国家食品药品监督管理总局通告2014年第9号)
(四)《医疗器械说明书和标签管理规定》(国家食品药品监督管理总局令第6号)
(五)《关于发布免于进行临床试验的第二类医疗器械目录的通告》(国家食品药品监督管理总局通告2014年第12号)
(六)《关于印发医疗器械生物学评价和审查指南的通知》(国食药监械〔2007〕345号)
(七)GB 4793.1—2007《测量、控制和实验室用电气设备的安全要求 第1部分:通用要求》
(八)GB 4793.9—2013《测量、控制和实验室用电气设备的安全要求 第9部分:实验室用分析和其他目的自动和半自动设备的特殊要求》
(九)GB/T 19634—2005《体外诊断检验系统自测用血糖监测系统通用技术条件》
(十)GB/T 18268.1—2010《测量、控制和实验室用的电气设备 电磁兼容性要求 第一部分:通用要求》
(十一)GB/T 18268.26—2010 《测量、控制和实验室用的电设备 电磁兼容性要求 第26部分:特殊要求 体外诊断(IVD)医疗设备》
(十二)YY 0648—2008《测量、控制和实验室用电气设备的安全要求 第2-101部分:体外诊断(IVD)医用设备的专用要求》
(十三)ISO 15197:2013《体外诊断检测系统-用于糖尿病管理的自测用血糖监测系统通用技术要求》
(十四)《关于发布医疗器械临床评价技术指导原则的通告》(国家食品药品监督管理总局通告2015年第14号)
(十五)国家食品药品监督管理部门发布的其他规范性文件。
三、重点内容说明
(一)按患者皮肤的损坏程度,血糖仪可分为有创型、微创型和无创型,其中有创型血糖仪是指需要采集受试者的血液进行检测的血糖仪,微创型血糖仪是指通过采集受试者表皮细胞间质液检测人体血糖的血糖仪(采集量低于0.3ul),无创型血糖仪是对人体不造成任何创伤检测人体血糖的血糖仪。本指导原则仅适用于有创型血糖仪。
(二)产品的结构和组成内容中,给出了血糖仪典型产品的结构示意图。
(三)在产品的工作原理中,简单介绍了血糖仪的工作原理。
(四)因产品为非治疗类医疗器械,故本指导原则不包含产品作用机理的内容。
(五)产品应适用的相关标准中给出了现行有效的国家标准、行业标准(包括产品标准、基础标准)。
(六)产品的主要风险中,参照YY/T 0316—2008《医疗器械 风险管理对医疗器械的应用》及其附录C、E、F、G、I、J中的相关规定,对血糖仪的安全性特征,危害、可预见的事件序列和危害处境判断,风险控制的方案与实施,综合剩余风险的可接受性评价及生产和生产后监视相关方法等方面做出了审查基本要求;同时,对血糖仪的危害、可预见的事件序列和危害处境判断进行了系统分析。
(七)产品的主要性能指标中给出了产品需要考虑的各个方面,有些需参照相关的国家标准、行业标准,有些则需要依据医疗器械注册申请人的技术能力。
(八)附录A参考卫生部办公厅关于印发《医疗机构便携式血糖检测仪管理和临床操作规范(试行)》通知中的内容制定;附录B参考文献资料《大气中氧含量与海拔高度的关系》中的内容制定;附录C参考FDA关于PQQ-GHD血糖监测技术存在致命风险警示中内容制定。
四、指导原则单位及人员
本指医疗器械产品注册导原则编写单位为天津市医疗器械技术审评中心。编写成员由天津市医疗器械审评中心技术审评人员、天津市市场与质量监督管理委员会行政审批人员、国家食品药品监督管理局天津医疗器械质量监督检验中心专家、血糖仪注册申请人代表、临床专家共同组成,充分收集各方面的信息和资源,综合考虑指导原则中各个方面的内容,尽量保证指导原则正确、全面、实用。
深圳鸿远医疗器械咨询有限公司 http://www.hongyuanyixiezixun.com专业代办医疗器械产品注册咨询代理、医疗器械生产许可证、医疗器械经营许可证、二类医疗器械经营备案、进口医疗器械注册、一类医疗器械产品备案及生产备案、FDA注册、ISO13485认证、 CE认证、计量器具生产许可证、临床试验、出口证,自由销售证等代理代办、医疗器械质量管理体系认证文件的建立及体系与过程确认文件的建立 (如:ISO9001、 ISO13485 、GMP、 CE、QSR820、CMDCAS)产品检测,临床试验及免临床资料编写、产品技术要求制订、技术文件编写辅导、洁净室建设指导等服务,技术专业,诚信服务,代理费用低,欢迎您咨询!
|