|
106-004《医疗器械注册证》许可事项变更
一、行政许可项目名称:
《医疗器械注册证》许可事项变更
二、行政许可内容
许可事项变更的受理及审批
三、设定行政许可的法律依据:
1、《医疗器械监督管理条例》(国务院令第650号)
2、《医疗器械注册管理办法》(国家食品药品监督管理总局令第4号)
四、行政许可数量及方式
无数量限制
五、行政许可条件
(一)广东省食品药品监督管理局核发的二类医疗器械注册证,注册证及其附件载明的内容发生变化。
(二)申请符合《医疗器械注册管理办法》要求。
(三)产品名称、型号、规格、结构及组成、适用范围、产品技术要求发生变化的,注册人应当向原注册部门申请许可事项变更。
六、申报资料目录及说明
(一)申请表
(二)证明性文件
境内注册人应当提交:
1.企业营业执照副本复印件。
2.组织机构代码证复印件。
(三)申请人关于变更情况的声明
(四)原医疗器械注册证及其附件复印件、历次医疗器械注册变更文件复印件
(五)变更申请项目对比表及说明
根据具体变更情况选择提交以下文件:
1.产品名称变化的对比表及说明;
2.产品技术要求变化的对比表及说明;
3.型号、规格变化的对比表及说明;
4.结构及组成变化的对比表及说明;
5.产品适用范围变化的对比表及说明;
6.注册证中“其他内容”变化的对比表及说明;
7.其他变化的说明。
(六)与产品变化相关的安全风险管理报告
(七)变化部分对产品安全性、有效性影响的资料
分析并说明变化部分对产品安全性、有效性的影响,并提供相关的研究资料。适用范围变化的必须提供临床评价资料。
(八)针对产品技术要求变化部分的注册检验报告
(九)符合性声明
1.注册人声明本产品符合《医疗器械注册管理办法》和相关法规要求;声明本产品符合现行国家标准、行业标准,并提供符合标准的清单;
2.注册人出具所提交资料真实性的自我保证声明。
七、申请材料一般要求
(一)网上申报
在递交书面申报材料前,应通过企业网上办事平台网上申报《医疗器械注册证》核发的电子版申请材料,并上传相应电子版(网上申报操作指引.pdf),取得预受理号,并在1个月内提交书面申请。企业在提交纸质申请材料时须同时提交预受理号。
(二)格式及其他要求
1.申请材料应清晰、整洁,使用A4规格纸张打印;
2.每项文件第一页作标签,或用带标签的隔页纸分隔,并按申报资料目录标明项目编号;
3.每项文件均应加盖企业公章;
4.按照申请材料目录的顺序装订成册;
5.用档案袋将报送的材料装好,档案袋需使用封面,格式见“档案袋封面格式”。
6.办理医疗器械注册申请事务的人员应当受申请人委托,应出示授权委托书及该办理人身份证明原件与复印件。
八、申请表格及文件下载
1、申请表(变更).doc
2、医疗器械注册申报资料要求及说明.doc
3、医疗器械安全有效基本要求清单.doc
4、授权委托书(参考样式).doc
5、资料装订.封面.目录(参考样式).doc
6、《关于发布医疗器械产品技术要求编写指导原则的通告》.doc
7、《关于进一步做好医疗器械产品分类界定工作的通知》.doc
8、《关于印发创新医疗器械特别审批程序(试行)的通知》.docx
9、免于进行临床试验的第二类医疗器械目录(通告2014年第12号附件).doc
10、实施《医疗器械注册管理办法》和《体外诊断试剂注册管理办法》有关事项的通知.doc
通知.doc
11、档案袋封面格式
九、行政许可申请受理机关
广东省食品药品监督管理局
受理地点:广州市东风东路753号之二一楼业务受理处
受理时间:每周一至周五上午9:00—12:00,下午13:00—17:00(逢周五下午不对外办公)
十、行政许可决定机关
广东省食品药品监督管理局
十一、行政许可程序
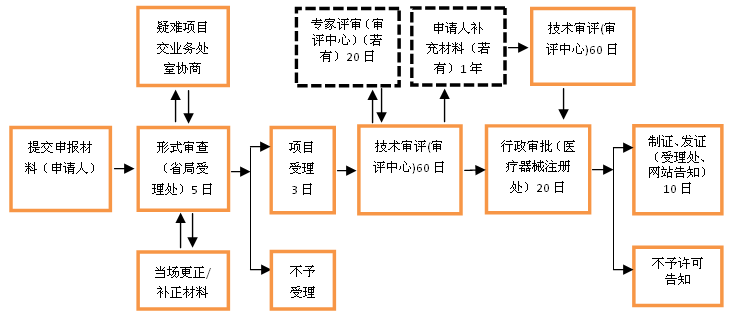
十二、行政许可时限
1.许可事项变更自受理之日起3个工作日内转交技术审评机构,60个工作日内完成技术审评工作,技术审评结束后20个工作日内作出审批决定。自作出审批决定之日起10个工作日内发给医疗器械注册变更文件。
2.专家审评、申请人补充资料的时间不计算在审评时限内。
十三、行政许可证件及有效期限
行政许可证件:医疗器械注册变更文件。
医疗器械注册变更文件与原医疗器械注册证合并使用,其有效期与该注册证相同。取得注册变更文件后,注册人应当根据变更内容自行修改产品技术要求、说明书和标签。
十四、行政许可收费:按有关部门批准收费
十五、行政许可年审或年检:无
十六、咨询与投诉机构
咨询:广东省食品药品监督管理局医疗器械咨询处
投诉:广东省食品药品监督管理局政策法规处
注:以上期限以工作日计算,不含法定节假日
本文来源于深圳鸿远医疗器械咨询有限公司 http://www.hongyuanyixiezixun.com,转载请您注明出处,谢谢!
|