|
第二类医用分子筛制氧设备,医疗器械分类代号现为6854产品的医疗器械注册证申报技术资料审查要点要求如下:
(一)产品名称的要求
医用分子筛制氧设备的命名应采用《医疗器械分类目录》或国家标准、医疗器械注册行业标准上的通用名称,或以产品结构和应用范围为依据命名,例如**医用分子筛制氧设备、**医用分子筛制氧机。

医疗器械产品注册证代理
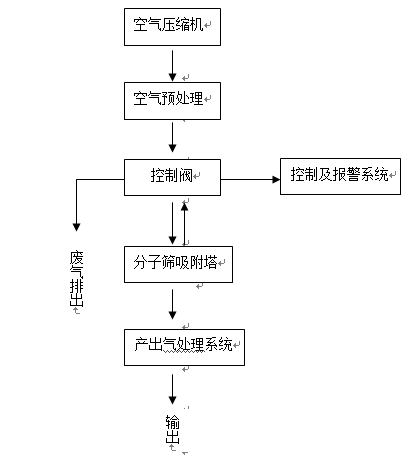
(二)产品的结构和组成
制氧设备一般应包括制氧主机、流量计和湿化器。
1.空气压缩机
提供吸附时所必须的气体压力及用于分离氧气的原料(空气)。
2.空气预处理
主要包括气体降温、除水、过滤等功能。
3.控制阀
控制经过空气预处理系统处理的压缩空气,进入分子筛吸附塔,进行周期性的加压、排气。
4.分子筛吸附塔
在密闭的容器中,密实地填充分子筛。利用分子筛对气体的选择性吸附特性,分离出空气中的氧气。
5.控制及报警系统
按照预先设定的工作程序,进行自动控制及故障报警。
注意:应提供氧浓度指示器,当氧浓度低于82%(V/V)时,发出报警。
6.产出气处理系统
主要指对制氧设备产生的氧气进行收集、过滤、调压、湿化等处理的部分。
(三)医疗器械注册证代理医用分子筛制氧设备产品工作原理
利用分子筛变压吸附原理。工作时,向一个装有分子筛的密闭容器内注入空气,容器内的压力会随之升高,其中的分子筛随着环境压力的升高,大量吸附空气中的氮气,而空气中的氧气则仍然以气体形式存在,并经一定的管道被收集起来。这个过程通常被称为“吸附”过程。当容器内的分子筛吸附氮气达到一定程度时,对容器进行排气减压,分子筛随着环境压力的减小,吸附氮气的能力下降,氮气自分子筛内部被释放,作为废气排出。这个过程通常被称为“解吸”。一般的制氧设备,为保证氧气持续稳定的产出,多采用两个(或多个)分子筛容器,通过控制,使一个容器处于吸附过程的同时,另一个容器处于解吸过程,反之亦然。
(四)产品作用机理
因该产品用途只是制取不小于90%(V/V)的氧气,故本指导原则不包含产品作用机理的内容。
(五)产品适用的相关标准
目前与医用分子筛制氧设备相关的国际标准、国家标准及行业标准
(六)医疗器械产品注册证办理医用分子筛制氧设备产品的预期用途
以空气为原料,利用分子筛变压吸附工艺生产氧浓度范围为90%~96%(V/V)的氧气(简称93%氧气)。
(七)产品的主要风险
医用分子筛制氧设备的风险管理报告应符合医疗器械注册证YY/T 0316《医疗器械 风险管理对医疗器械的应用》的有关要求,审查要点包括:
1.产品定性定量分析是否准确。
2.危害分析是否全面。
3.风险可接收准则,降低风险的措施及采取措施后风险的可接收程度,是否有新的风险产生。
以下依据YY/T 0316从各方面列举了产品的危害因素,提示审查人员从以下方面考虑。
(八)医疗器械产品注册证申报产品的主要技术指标
对产品的主要性能指标的审查,可以通过对检验报告内容的审查来评价是否达到了要求,检验报告的内容是否齐全又可以通过对产品标准的内容是否齐全来进行审查。因此产品标准的审查是产品主要技术性能指标审查中最重要的环节之一。
(九)医疗器械产品注册证代理医用分子筛制氧设备产品的检测要求
产品的检测包括出厂检验和型式检验。
出厂检验项目应至少包括外观、氧产量、氧浓度、漏电流、电介质强度、保护接地阻抗、气密性及控制功能验证。
型式检验为全性能检验。
(十)产品的临床要求
医疗器械注册咨询医用分子筛制氧设备的注册证申报根据《关于印发豁免提交临床试验资料的第二类医疗器械目录(试行)的通知》(国食药监械[2011]475号)的要求,申报该产品可以提交其与已上市同类产品的对比说明,豁免提交临床试验资料。
(十一)该类产品的不良事件历史记录
暂未见相关报道。
(十二)产品说明书、标签和包装标识
医疗器械注册证代理产品说明书一般包括使用说明书和技术说明书,两者可合并。说明书、标签和包装标识应符合《医疗器械说明书、标签和包装标识管理办法》的规定,并参照GB9706.1《医用电气设备 第一部分:安全通用要求》等标准的要求进行编写。
本文来源于:医疗器械注册证 医疗器械产品注册证
|