|
办理医疗器械产品注册证
医疗器械注册证代理根据牙科手机注册技术审查指导原则(2017年修订版)产品说明书一般包括使用说明书和技术说明书,两者可合并。说明书、标签应符合《医疗器械说明书和标签管理规定》(国家食品药品监督管理总局令第6号)及相关标准的规定。
1.说明书的内容
除符合《医疗器械说明书和标签管理规定》(国家食品药品监督管理总局令第6号)和相关标准中的要求之外,手机的说明书还应至少明确以下信息:
(1)明确牙科手机(含易损件如轴承、光导管,水路,气路等)的灭菌、维护、保养说明;明确灭菌周期的重要参数,例如时间、温度;明确干燥说明。
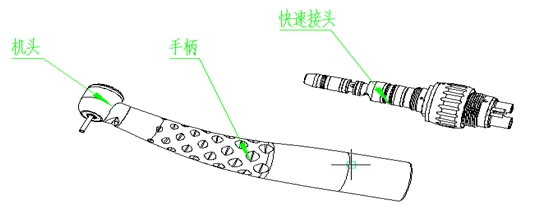
(2)明确夹持的手术器械类型(如车针)、规格、尺寸。
(3)若为气源驱动的手机,明确压缩空气的供气压力及基本要求。
(4)若带水冷却,明确水冷却方式(外给水、内给水),水源的压力及基本要求。
(5)在驱动马达的最大转速下,手机的空载转速。
(6)明确手机夹头形式、软管连接件类型(如适用,参照YY/T0514进行明确)、联轴节类型。
(7)若带水冷却,明确水冷却方式(外给水/内给水),水源的压力及基本要求。
2.医疗器械产品注册证代理禁忌症、注意事项、警示及提示性说明
(1)应仔细阅读、理解说明书中全部内容方可操作。
(2)操作时应遵循仪器上的全部警示和说明。
(3)本产品是特为口腔治疗而制造,不能作为其他用途。
(4)本产品为高速旋转手机,使用时请注意安全。
(5)本产品仅限于专业口腔科医生使用。
(6)每次使用时,请预先在患者的口腔外进行运转检查。若发觉有松动、振动、杂音或发热等异常现象,请立即停止使用,并与原经销商联系。
(7)已损坏的手机机芯有可能会产生很高的噪音,长时间使用会影响听力,请及早更换。
(8)为免手机严重损坏,请避免手机受到撞击或不小心掉落。
(9)使用的车针应符合医疗器械产品注册证YY 0302.1—2010的标准。使用车针时,必须了解车针的规定转速和规格是否符合本手机使用。使用弯曲、有裂纹、变形、已损坏及不符合规格的车针,可能会导致运转过程中突然折断、飞出等事故,造成伤害,以及损坏手机。
(10)气源、水源的压力和流量必须达到本机的要求。进气压力过高,会导致手机涡轮转速过高,而损坏轴承。
(11)可用通针疏通喷孔。
(12)产品储存和运输应在干燥、稳定(无摔碰)、远离酸碱等有害化学物质及气体的洁净的常温、常压、湿度小于90%的环境中。
(13)产品使用寿命末期光纤导光棒为玻璃制品,按玻璃制品环保要求处理,其余金属可进行分类回收处理,LED灯是电子产品应按《废弃电器电子产品回收处理管理条例》处理。
(14)本产品的维修需由专业人员负责。
(15)为确保手机的使用寿命,应使用干燥、洁净的压缩空气并定期维护空气压缩机及气、水过滤系统以保证压缩空气及水的质量,使用未过滤的水将导致管道接头的堵塞。
(16)车针夹持部分不可过短,否则轴承负荷不均,加快轴承磨损。
(17)请保持车针夹头的清洁,避免内部因存有污物而导致车针夹持力减弱或机芯振动。
(18)手机未装上车针时,不得通气旋转,否则将损坏轴承。
(19)请在旋转完全停止后,再进行车针或手机的装卸,切勿在旋转中按压机头盖。
(20)手机如是扭针式芯轴,不工作或长时间存放时,请预先清洗和上油,并装上车针或标准棒,如是按压式芯轴,请拆卸车针和标准棒,避免芯轴疲劳磨损。
(21)当手机表面沾有药品时,经高温消毒灭菌后,有可能致使手机表面镀层脱落或发黑,因此必须特别注意。
(22)端盖与手机头上的螺纹极为精细,打开时应先将扳手放在端盖适当的位置,对准后才扭动,以免损伤螺纹。
(23)在装入新机芯前,注意清洁手机机头内部。
(24)血友病患者慎用。
(25)带有心脏起搏器的患者或医生慎用电动马达驱动手机。
(26)心脏病患者、孕妇及幼儿慎用。
3.医疗器械注册证代理应当在说明书中明确重复使用的处理过程,包括清洁、消毒、包装及灭菌的方法和重复使用的次数或者其他限制。
4.标签
手机标签应当包括以下内容:
(1)产品名称、型号、规格。
(2)注册人的名称、住所、联系方式。
(3)医疗器械注册证编号。
(4)生产企业的名称、住所、生产地址、联系方式及生产许可证编号,委托生产的还应当标注受托企业的名称、住所、生产地址、生产许可证编号。
(5)生产日期,使用期限或者失效日期。
(6)电源连接条件、输入功率(如适用)。
(7)根据产品特性应当标注的图形、符号以及其他相关内容。
(8)必要的警示、注意事项。
(9)特殊储存、操作条件或者说明。
医疗器械注册证办理医疗器械标签因位置或者大小受限而无法全部标明上述内容的,至少应当标注产品名称、型号、规格、生产日期和使用期限或者失效日期,并在标签中明确“其他内容详见说明书”。
深圳鸿远医疗器械咨询有限公司是一家技术专业的医疗器械咨询服务公司,专注提供全国各地如:深圳、广州、东莞、中山、佛山、潮州、顺德、上海、西安、重庆、成都等知名城市的医疗器械领域技术咨询服务。专业的医疗器械注册证咨询代理代办、医疗器械生产许可证、三类医疗器械经营许可证、二类医疗器械经营备案、进口医疗器械注册、一类医疗器械产品备案及生产备案、FDA注册、ISO13485认证、 CE认证、计量器具生产许可证、临床试验、出口证,自由销售证等代理代办、医疗器械质量管理体系认证文件的建立及体系与过程确认文件的建立 (如:ISO9001、 ISO13485 、GMP、 CE、QSR820、CMDCAS)产品检测,临床试验及免临床资料编写、产品技术要求制订、技术文件编写辅导、医疗器械广告批文申请办理、洁净室建设指导等服务,技术专业,诚信服务,代理费用低,欢迎您咨询!
|