|
医疗器械输液泵注册临床评价申请人应依据产品的具体特性确定其中内容是否适用,若不适用,需具体阐述理由及相应的科学依据,并依据产品的具体特性对注册申报资料的内容进行充实和细化。
输液辅助装置中的输液泵,按第二类医疗器械管理。
产品的命名应符合《医疗器械通用名称命名规则》(国家食品药品监督管理总局令第19号)和国家标准、行业标准中的通用名称要求,如:输液泵。
输液泵产品的结构和组成:
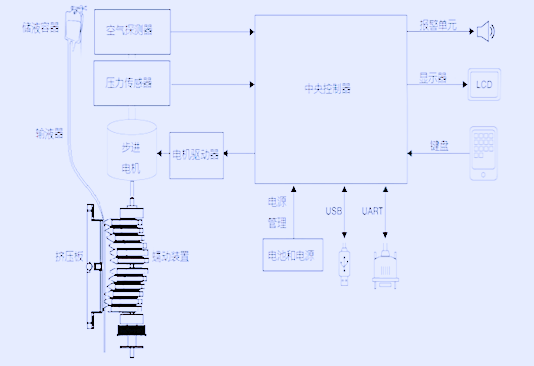
该产品主要由控制系统、电机驱动单元、蠕动挤压机构、检测装置、报警装置、输入及显示装置、壳体及其支撑结构、软件组件组成。
产品结构组成中不包含输注管路,但生产企业应在产品研究资料及说明书等相关注册申报资料中详细说明配套输液管路的具体要求。
控制系统:是对输液泵进行智能控制和管理的核心单元,其对检测信号进行处理,并根据处理结果下达指令,以保证输液泵的安全有效运行。
电机驱动单元:接受控制系统的转速和位置等指令,驱动电机按照指定的转速及转向工作。
蠕动挤压结构:将电机的转动转化成泵片的直线往复运动,多个泵片依序的往复运动以推动输液管路中的液体定向流动。
检测装置:其作用是将检测到的信号进行处理后传输至控制系统。其中,滴数传感器(如有)负责对液体流速和流量的检测;压力传感器负责堵塞及漏液的检测;气泡传感器负责对气泡的检测等。
报警装置:其响应控制系统发出的报警指令,发出声光报警。
输入及显示装置:输入装置负责设定参数。显示装置负责参数、工作状态及和输液器标识匹配信息的显示等,多采用LED数码管显示和LCD液晶显示。
壳体及其支撑结构:是输液泵各系统的安装载体和外部防护,同时对于电击和电磁干扰提供必要的隔离保护措施。
软件组件:配合输液泵各系统部件一起实现输液泵各项功能。
医疗器械输液泵产品的临床评价要求
注册申请人应根据《医疗器械临床评价技术指导原则》(国家食品药品监督管理总局通告2015年第14号)的相关要求提交临床评价资料。
对于列入免于进行临床试验医疗器械目录(国家食品药品监督管理总局通告2014年第12号,2016年第133号,2017年第170号)的产品,申请人按照《医疗器械临床评价技术指导原则》的豁免临床要求,提供相应临床评价资料。
针对申报产品与对比产品所不相同的功能特点,申请人应针对该功能特点进行临床评价,提交临床评价资料,例如具有加温功能。
深圳鸿远医疗器械咨询有限公司是一家技术专业的医疗器械咨询服务公司,专注提供全国各地如:深圳、广州、东莞、中山、佛山、潮州、顺德、上海、西安、重庆、成都等知名城市的医疗器械领域技术咨询服务。专业的医疗器械产品注册证咨询代办理、医疗器械产品分类界定代办理、医疗器械生产许可证、三类医疗器械经营许可证、二类医疗器械经营备案、进口医疗器械注册、一类医疗器械产品备案及生产备案、FDA注册、ISO13485认证、 CE认证、计量器具生产许可证、临床试验、出口证,自由销售证等代办理、医疗器械质量管理体系认证文件的建立及体系与过程确认文件的建立 (如:ISO9001、 ISO13485 、GMP、 CE、QSR820、CMDCAS)产品检测,临床试验及免临床资料编写、产品技术要求制订、技术文件编写辅导、电磁兼容整改、医疗器械广告批文申请办理、洁净室建设指导等服务,技术专业,诚信服务,代理费用低,欢迎您咨询!
|