|
医疗器械注册YY 0060-2018《热敷贴(袋)》(注:本指导原则中标准适用于最新版本,下同。)所规定的将主要材料成份(铁粉、水、活性炭、食盐等,且不含任何药物成分),按一定比例放入内袋密封,利用铁粉氧化的升温致热原理,通过热传导作用方式对患者进行辅助治疗的贴敷类产品。
多功能敷贴类产品(如具有磁疗、远红外等功能)的热敷贴(袋)部分,应适用于本指导原则。
不适用于:
含有化学成分、中药材(或天然植物)及其提取物等,所含成分发挥药理学、免疫学或者代谢作用的贴敷类产品;
含有化学成分、中药材(或天然植物)及其提取物等,不能证明不发挥药理学、免疫学或者代谢作用的贴敷类产品。
医疗器械产品注册热敷贴(袋)在《关于发布医疗器械分类目录的公告》(国家食品药品监督管理总局公告2017年第104号)中,热敷贴(袋)的管理类别为二类,
产品分类编码为09-02-01。
产品名称应为通用名称,并符合《医疗器械通用名称命名规则》(国家食品药品监督管理总局令第19号)等相关法规、规范性文件的要求。核心词为“热敷贴(袋)”,特征词1产品作用方式(指产品与人体接触方式),如直接接触皮肤产品为接触式,不直接接触皮肤产品为非接触式等,特征词2产品结构特点(产品主体结构方面的特有属性),如粘贴式和非粘贴式等;特征词3按产品使用部位(指产品发挥其主要功能的患者部位),如关节和颈椎等。
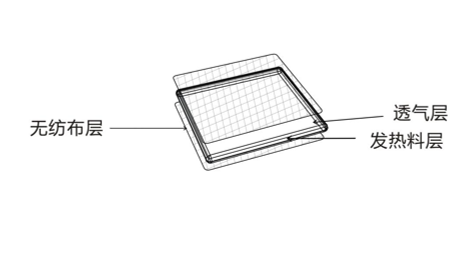
那么医疗器械热敷贴(袋)产品注册产品的临床评价怎么编写呢?
医疗器械热敷贴(袋)产品注册产品的临床评价根据《关于公布新修订免于进行临床试验医疗器械目录的通告》(国家药品监督管理局通告2018年第94号,以下简称《目录》)的规定,热敷贴(袋)可以豁免临床试验,注册申请人需提交申报产品相关信息与《目录》所述内容的对比资料和申报产品与已获准境内注册的《目录》中医疗器械的对比说明。
深圳鸿远医疗器械咨询有限公司是一家技术专业的医疗器械咨询公司,专注提供全国各地如:深圳、广州、东莞、中山、佛山、潮州、顺德、上海、西安、重庆、成都等知名城市的医疗器械领域技术咨询服务。鸿远医疗器械咨询专业服务于:医疗器械产品注册证、医疗器械生产许可证、进口医疗器械注册、体外诊断试剂注册代办理咨询、一类医疗器械产品备案及生产备案代办、医疗器械经营许可证代办、二类医疗器械经营备案、CE认证、ISO13485认证、FDA注册、临床试验、医疗器械质量管理体系认证及体系建立与过程确认文件建立(ISO9001, ISO13485, GMP, CE,QSR820,CMDCAS);产品技术要求制订、技术文件、临床试验及免临床同类产品比对比资料编写、注册资料编写辅导、电磁兼容预测整改、医疗器械广告批文申报、医疗器械出口销售证明办理、洁净室建设指导等提供一站式服务,技术专业,诚信服务,欢迎您咨询!
|